| Главная » Статьи » Мои публикации |
РАЦИОНАЛЬНАЯ АНТИБИОТИКОТЕРАПИЯ ПРИ МЕХАНИЧЕСКОЙ ЖЕЛТУХЕ И ГНОЙНОМ ХОЛАНГИТЕ
Введение. Одну из ключевых позиций в современной концепции лечения обтурационного холестаза занимает проведение адекватной антибактериальной терапии, направленной на купирование гнойного холангита и предупреждение внутрибрюшных послеоперационных осложнений, билиарного сепсиса [1]. Внедрение малоинвазивных технологий видоизменило хирургическую тактику. Широкое применение чрескожной пункционной холангиостомии под УЗИ-контролем, эндоскопической папиллосфинктеротомии, назобилиарного дренирования стало основой этапного хирургического лечения [2, 3 ,4].
Однако в литературе появились данные, что адекватное наружное дренирование желчных путей при механической желтухе не всегда решает проблему холангита. Имеются сведения, что при двухэтапном методе лечения декомпрессионное дренирование способствует росту микроорганизмов в желчи, что достоверно коррелирует с гнойно-септическими осложнениями на втором этапе хирургического лечения [5, 6]. Не вполне ясен путь колонизации билиарного дерева при механической желтухе [6]. В литературе мы не нашли результатов исследований, касающихся динамики флоры желчных путей в ближайшем послеоперационном периоде, поэтому сочли необходимым провести такую работу, а также изучить основные механизмы бактериальной контаминации желчи при обструкции билиарного дерева и теоретически обосновать подходы к решению этой важнейшей проблемы.
Цель исследования: разработка стратегии антимикробной терапии при механической желтухе и гнойном холангите. Материал и методы. Провели анализ результатов лечения 518 пациентов с синдромом механической желтухи, в том числе 365 больных пожилого и старческого возраста, находившихся под наблюдением в МЛПУ “Городская больница №35”.
В эту группу вошли 270 лиц с обтурационным холестазом неопухолевой этиологии и 95 пациентов с онкопатологией. У больных с неопухолевой этиологией желтухи самыми частыми причинами были холедохолитиаз и стеноз терминального отдела холедоха, у лиц с онкопатологией – рак головки поджелудочной железы. Анализ флоры желчных путей проводили стандартным бактериологическим методом, включающим посев на специальные среды, выделение чистой культуры, идентификацию микроорганизмов ферментным способом, определение чувствительности к антибиотикам при помощи набора дисков. Выполнили две серии исследований. В первой производили посев желчи, взятой интраоперационно или в ближайшие часы после оперативного вмешательства. Результаты анализировали с целью определения способов рационального профилактического применения антибиотиков в периоперационном периоде. Во второй серии использовали пробы желчи из дренажей холедоха на 5 - 8 сутки. Полученные данные служили для выбора антибактериальной терапии осложнений раннего послеоперационного периода, поскольку, по данным литературы, большинство серьезных проблем наблюдается именно в эти сроки (недостаточность анастомоза, перитонит, дислокация дренажей, внутрибрюшные гематомы).
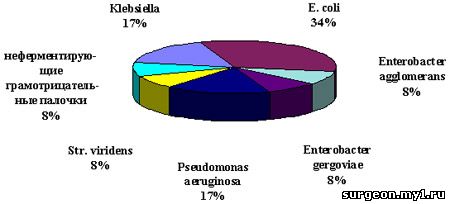
Результаты. Желчь была бактериально контаминированной в высоких титрах (104 - 105 КОЕ/мл) в 100% случаев. В первой серии исследований чаще всего наблюдали монокультуру (67%). Доминирующую позицию среди микроорганизмов желчи на момент операции занимают E.coli, Klebsiella и Pseudomonas aeruginosa (рис. 1). Встречались также Enterobacter gergoviae, Enterobacter agglomerans, Str. viridens, неферментирующие грамотрицательные палочки.
Рис. 1. Флора желчных путей на момент операции.
У больных в возрасте до 70 лет в 80% случаев идентифицирована монокультура, у лиц старше 70 лет микробные ассоциации выделены в 50% посевов, что следует учитывать, планируя назначение антибиотиков. Несмотря на столь значительное разнообразие микроорганизмов, на момент хирургического вмешательства флора в 72% случаев была высокочувствительна к традиционно используемым в хирургии препаратам - комбинации полусинтетических пенициллинов с аминогликозидами и цефалоспоринам первых поколений. Во второй серии исследований в 80% анализов наблюдали микробные ассоциации. Флора желчных путей на 5 – 8 сутки послеоперационного периода была еще более разнообразной (рис. 2).
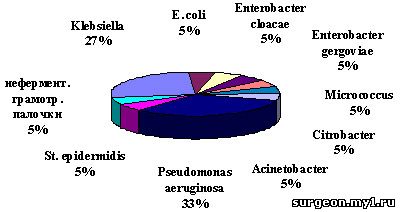 Рис. 2. Флора желчных путей на 5 - 8 сутки послеоперационного периода
В эти сроки послеоперационного периода E. coli уступает свои доминирующие позиции в пользу Pseudomonas aeruginosa, что следует учесть, планируя назначение антибиотиков. Часто встречаются также Enterobacter cloacae, Enterobacter gergoviae, Micrococcus, Citrobacter, St. epidermidis, неферментирующие грамотрицательные палочки. К этому моменту радикально меняется чувствительность микроорганизмов к вводимым антибактериальным препаратам. Флора абсолютно резистентна к полусинтетическим пенициллинам, аминогликозидам, цефалоспоринам первых поколений. Эффективны цефтриаксон, цефтазидим, ципрофлоксацин, пефлоксацин, имипенем и меропенем.
Обсуждение. Значительная доля монокультуры в первой серии исследований несколько отличается от литературных данных [6]. Выявленный в ходе работы уровень контаминации желчи (100%) также не полностью согласуется с результатами других исследователей [7]. Ведущая роль E.coli, Pseudomonas aeruginosa, Klebsiella соответствует данным литературы [7, 8] Некоторые авторы сообщают о практически одинаковой эффективности новых бета-лактамных препаратов и комбинации ампициллина и гентамицина у большинства пациентов, за исключением самых тяжелых [8]. Нами установлено, что в ряде случаев микроорганизмы могут быть устойчивы, например, к карбапенемам, но высокочувствительны к фторхинолонам, следовательно, при высоком риске послеоперационных осложнений бактериологический контроль будет весьма полезным. В литературе имеются указания на то, что при двухэтапном методе лечения декомпрессионное дренирование способствует росту микроорганизмов в желчи, что достоверно коррелирует с гнойно-септическими осложнениями на втором этапе хирургического лечения [5, 6].
Эти данные не противоречат результатам наших исследований и полностью согласуются с патогенезом желтухи и гнойного холангита. В норме желчь содержит микроорганизмы в невысоких титрах [9]. Что же происходит при непроходимости желчных путей? Мы не поддерживаем точку зрения Nomura T. et al. о роли транспапиллярного рефлюкса в механизме бактериальной контаминации желчи [10]. Считаем, что при билиарном блоке какой-либо рефлюкс невозможен, во-первых, из-за имеющегося препятствия, а во-вторых, из-за крайне высокого при обтурационном холестазе градиента давления. Кроме того, по данным той же группы исследователей, обсемененность желчи достоверно выше при проксимальном билиарном блоке, чем при дистальном. Ведущая роль в механизме бактериальной контаминации желчи принадлежит нарушению нормальной рециркуляции пула желчных кислот. При этом происходит физическое неспецифическое повреждение интестинального слизистого барьера, реализующееся на клеточном уровне путем апоптоза, более всего в подвздошной кишке [11]. Повреждение ворсинок, соединительнотканных структур ведет к прямому контакту кишечного содержимого с лимфатическими сосудами [12].
Это способствует колонизации и транслокации кишечной микрофлоры, резорбции кишечного эндотоксина, оказывающего иммунодепрессивное действие через клетки Купфера и фактор некроза опухолей [13, 14, 15, 16, 17].
Миграция бактерий в кровь и лимфу усиливает эндотоксикоз, ведет к локальным и системным гнойным осложнениям [18, 19, 20]. Декомпрессия желчных путей снижает поступление микроорганизмов в системный кровоток и купирует симптомы холангита, но не деконтаминирует билиарное дерево. Антибиотикотерапия на этом фоне приводит к селекции высокорезистентной флоры. Поэтому при этапном хирургическом лечении больных с механической желтухой гнойно-воспалительные осложнения на втором этапе в ряде случаев имеют место чаще, чем при одномоментной коррекции непроходимости желчных путей.
С учетом вышеизложенного, наружное декомпрессивное дренирование желчных путей должно быть кратковременным. В качестве метода борьбы с колонизацией билиарного дерева методом выбора является внутреннее дренирование желчных путей. При временном наружном дренировании необходим энтеральный возврат желчи. Целесообразно комбинировать эти методы с ксимедоном, обладающим свойством как стимулятора репаративных процессов, иммуномодулятора, так и антимикробного средства [21, 22, 23, 24, 25]. Полученные данные мы включили в лечебно-диагностическую программу у пациентов пожилого и старческого возраста с механической желтухой и гнойным холангитом как один из ее важнейших этапов.
Изучили ее эффективность путем анализа результатов хирургического лечения в двух группах пациентов. К первой отнесены лица, в диагностике и лечении которых соблюдены основные этапы нашей лечебно-диагностической программы (n=319). Во вторую группу вошли пациенты, у которых ее основные разделы выполнить не удалось (n=46). Среди лиц, которым применена обоснованная нами диагностическая и лечебная тактика, осложнения наблюдались в 4,3% случаев, летальность составила 3,4% (p<0,05). Во второй группе пациентов количество осложнений достигало 19%, а летальность – 13% (p<0,05).
Заключение. Пациентам с обтурационным холестазом необходимо проведение превентивной антибиотикотерапии с момента госпитализации из-за угрозы прогрессирования гнойного холангита вследствие 100% бактериальной контаминированности желчи в высоких титрах. Периоперационное введение антибиотиков должно включать типичные для “условно-загрязненных” вмешательств препараты с учетом степени их экскреции в желчь и чувствительности к ним основных представителей билиарной флоры. Антибиотикотерапия может быть начата с цефалоспоринов 1 поколения или комбинации "полусинтетический пенициллин + аминогликозид".
При гнойном холангите терапию следует дополнить метронидазолом. Наружное дренирование протоков не деконтаминирует желчные пути. Только внутреннее дренирование решает проблему восстановления циркуляции пула желчных кислот, восстановления барьерных функций кишечной стенки и адекватной санации билиарного дерева. На 5 – 8 сутки послеоперационного периода (сроки возможного развития внутрибрюшных осложнений) микробный пейзаж желчных путей существенно меняется в сторону полиморфной резистентной флоры. В эти сроки следует применять только препараты резерва. Для второго курса следует выбрать антибиотик из другой фармакологической группы.
Препаратами выбора являются антибиотики с высокой степенью экскреции в желчь, антисинегнойной активностью (цефтриаксон, цефтазидим, пефлоксацин). Предпочтительный путь введения медикаментов - внутривенный. Применение деэскалационного метода решает проблему резистентности. Использование цефалоспоринов 4 поколения до декомпрессии желчных путей чревато развитием эндотоксического шока. Дальнейшие исследования в направлении оптимизации антибиотикотерапии при механической желтухе и гнойном холангите представляются нам весьма актуальными и перспективными.
Литература
1. Гальперин Э.И., Ахаладзе Г.Г. Билиарный сепсис: некоторые особенности патогенеза // Хирургия. - 1999. - №10. 2. Выбор операции при желчнокаменной болезни и ее осложнениях / Кукош М.В., Гомозов Г.И., Емельянов Н.В. и др. // Ниж. мед. журнал. - 2000. - №4. - С. 54 - 57. 3. Хирургическая тактика у больных хроническим калькулезным холециститом, осложненным холедохолитиазом / Джаркенов Т.А., Мовчун А.А., Хрусталева М.В. и др. // Хирургия. - 2004. - №3. - С. 13 - 17. 4. Непосредственные и отдаленные результаты эндоскопической папиллотомии при доброкачественной непроходимости терминального отдела гепатикохоледоха. / Сатин А.В. Сб. мат.научно-практ.конф. врачей. - Тверь, 2002. - С. 124 - 127. 5. Biliary bacterial infection in liver surgery / Arai T., Nagino M., Nimura Y. // Nippon Geka Gakkai Zasshi. – 2002. - Vol.103(12). - P. 869 - 872. 6. Preoperative Biliary Drainage: Impact on Intraoperative Bile Cultures and Infectious Morbidity and Mortality After Pancreaticoduodenectomy / Povoski S.P., Karpeh M.S.Jr., Conlon K.C. // J. Gastrointest. Surg. - 1999. - Vol.3(5). - P. 496 - 505. 7. Bile cultures and sensitivity patterns in malignant obstructive jaundice / Neve R., Biswas S., Dhir V. // Indian J. Gastroenterol. - 2003. - Vol.22(1). - P. 16 - 18. 8. Biliary tract infections: a guide to drug treatment / Westphal J.F., Brogard J.M. // Drugs. - 1999. - Vol.57(1). - P. 81 - 91. 9. Подымова С.Д. Дифференциальная диагностика желтух // Клин. мед. - 2003. - №12. - С. 66 - 71. 10. Bacteribilia and cholangitis after percutaneous transhepatic biliary drainage for malignant biliary obstruction. / Nomura T., Shirai Y., Hatakeyama K. // Dig Dis Sci. – 1999. - Vol.44(3) - P. 542 – 546. 11. Bacterial translocation and intestinal morphological findings in jaundiced rats / Sileri P., Morini S., Sica G.S. // Dig. Dis. Sci. - 2002. - Vol.47(4). - P. 929 - 934. 12. Bacterial translocation in obstructive jaundice in rats: role of mucosal lacteals / Kordzaya D.J., Goderdzishvili V.T. // Eur. J. Surg. - 2000. - Vol.166(5). - P. 367 - 374. 13. Depressed cytotoxic activity of hepatic nonparenchymal cells in rats with obstructive jaundice / Hirazawa K., Hazama S., Oka M. // Surgery. - 1999. - Vol.126(5). - P. 900 - 907. 14. Kupffer cell blockade, tumour necrosis factor secretion and survival following endotoxin challenge in experimental biliary obstruction / Kennedy J.A., Lewis H., Clements W.D. // Br. J. Surg. - 1999. - Vol.86(11). - P. 1410 - 1414. 15. Effects of granulocyte colony-stimulating factor (g-csf) on neutrophil phagocytosis during experimental obstructive jaundice / Aldemir B., Canturk Z., Ilbay G. // Ulus Travma Derg. - 2002. - Vol.8(3). - P. 137 - 141. 16. Kupffer cell phagocytosis blockade decreases morbidity in endotoxemic rats with obstructive jaundice / Lazar G. Jr., Paszt A., Kaszaki J. // Inflamm. Res. - 2002. - Vol.51(10). - P. 511 - 518. 17. Biliary obstruction reduces hepatic killing and phagocytic clearance of circulating microorganisms in rats / Hoshino S., Sun Z., Uchikura K. // J. Gastrointest. Surg. - 2003. - Vol.7(4). - P. 497 - 506. 18. Bacterial translocation from the biliary tract to blood and lymph in rats with obstructive jaundice / Karsten T.M., van Gulik T.M., Spanjaard L. // J. Surg. Res. - 1998. - Vol.74(2). - P. 125 - 130. 19. Obstructive jaundice promotes bacterial translocation in humans / Kuzu M.A., Kale I.T., Col C. // Hepatogastroenterology. - 1999. - Vol.46(28). - P. 2159 - 2164. 20. Short and long-term effects of bacterial translocation due to obstructive jaundice on liver damage / Sakrak O., Akpinar M., Bedirli A. // Hepatogastroenterology. - 2003. - Vol.50(53). - P. 1542 - 1546. 21. Антимикробное средство / Кочнев О.С., Измайлов С.Г., Резник В.С., Федоров Р.В. // Изобретения. - 1995. - №21. 22. Вещество, проявляющее иммуностимулирующую активность / Цибулькин А.П., Слабнов Ю.Д., Терещенко В.Ю. и др. // Изобретения. - 1992. - А.с. 1830695. 23. Патент РФ на изобретение, МПК 7 A 61 K 31/517, A 61 P 1/16, 39/00 №2195283. Гепатопротекторное и детоксикационное средство для лечения и профилактики гнойно-септических заболеваний / Институт органической и физической химии им. А.Е.Арбузова Казанского научного центра РАН. – 2001110447/14; Заявл. 17.04.2001.; Опубл. 27.12.2002.; Бюл. №36. (Авт.: Измайлов Г.А., Измайлов С.Г., Резник В.С., Паршиков В.В. и др.). 24. Способ лечения механической желтухи. Измайлов С.Г., Измайлов Г.А., Резник В.С., Паршиков В.В. и др. Положительное решение от 16.04.2008 о выдаче патента РФ по заявке №2006119843 14(021561)). 25. В.В.Паршиков, С.Г.Измайлов. Профилактика осложнений при наложении холедоходуоденоанастомоза у больных пожилого и старческого возраста с помощью прецизионного адаптирующего шва и ксимедона // Ниж. мед. журнал. - 2005. - №2. - С. 102 - 108. | |
| Категория: Мои публикации | Добавил: surgeon (04.03.2009) | |
| Просмотров: 3231 |
Категории каталога
| Мои публикации [47] |
|
Герниология
[14]
Материалы по хирургическому лечению грыж
|
|
Панкреатология
[10]
Все материалы по хирургии поджелудочной железы
|
| Послеоперационный период. Детская челюстно-лицевая хирургия. [3] |
Поиск
Наш опрос
| Copyright MyCorp © 2024 |
| Бесплатный хостинг uCoz |