| Главная » Статьи » Мои публикации |
В работе представлены результаты морфологического исследования процессов, происходящих в зоне имплантации синтетического материала при создании экспериментальной модели вентральной грыжи. Изучена последовательность развития репаративных процессов, дана сравнительная характеристика реакции тканей на имплантацию реперена и полипропилена. Доказана универсальность репаративных процессов, происходящих в зоне имплантации, выявлены особенности при различных способах имплантации: onlay, inlay, sublay, а так же зависимость скорости репарации от степени удаленности от эпицентра фрагмента имплантата. Установлена зависимость архитектоники формирующегося рубца в зоне имплантации от структуры имплантата. Выявлен ряд принципиальных преимуществ у реперена по сравнению с полипропиленом при пластике грыжевых ворот. Дан анализ оперативного лечения вентральных грыж по ненатяжным методикам с применением реперена в клинике. Изучены ближайшие послеоперационные результаты. Проблема хирургического лечения вентральных грыж носит как медицинскую, так и социально-экономическую направленность [1,2,7]. Это связано с высоким процентом грыженосительства, неудовлетворительными результатами оперативного лечения послеоперационных вентральных грыж, больших паховых грыж, особенно рецидивных [6,7,8,12]. Успехи современной герниологии обусловлены внедрением в практику атензионных способов оперативного лечения с применением сетчатых эндопротезов из синтетических полимеров (полиэстер, полипропилен и политетрафторэтилен), что позволяет уменьшить количество рецидивов до 1.1-2.2% [8,13]. Однако при их использовании в ряде случаев наблюдаются осложнения - нагноения послеоперационных ран, инфильтраты, серомы, келоидные трансформации послеоперационных рубцов. Они обусловлены реакцией организма на материал сетки и фитильными свойствами последнего [2,7,12]. При имплантации в ткани эндопротезы имеют тенденцию к сокращению в размерах, что способствует развитию рецидива грыжи. Отрыв сетки в месте фиксации в области грыжевых ворот может привести к ранним рецидивам, вплоть до эвентрации [2,10,13]. Способность аллотрансплантата вызывать адгезивный процесс при непосредственном контакте с органами брюшной полости вызывает у ряда больных опасные интраабдоминальные осложнения, такие как ранняя спаечная кишечная непроходимость, кишечные свищи [2,9,10]. Эти проявления требуют системного подхода к выбору пластического материала при различных видах грыж, способу пластики, а так же учитывать степень инфицированности операционного поля. Поэтому поиск идеального эндопротеза весьма актуален [7,8,9]. Материал для него должен отвечать следующим критериям:
Весьма перспективным в этом отношении, по нашему мнению, является принципиально новый синтетический материал реперен. Это пространственно-сшитый полимер из олигомеров метакрилового ряда, гидрофобный, устойчивый к воздействию биологически активных и агрессивных жидкостей. Данный материал является продуктом, выпускаемым ООО «Репер-НН» с 1996г. Реперен хорошо зарекомендовал себя в качестве интраокулярных линз, применяемых в офтальмологии, компрессионных пластин, используемых в комбустиологии с целью лечения ожоговых ран [16,17]. Реперен активно используется как пластический материал для замещения хрящей ушной раковины, носовой перегородки в оториноларингологии, ведутся экспериментально-клинические испытания применения реперена для краниопластики в нейрохирургии. Для проблем герниологии реперен выпускается в виде пластин толщиной от 300 до 800 мкм, размерами от 5 до 30 см в зависимости от потребности хирурга [16]. Метод фотохимического синтеза, стоящий в основе производства реперена, является уникальным и позволяет синтезировать имплантаты любой толщины и размера. Изделия стерильны, метод стерилизации - газовый, пластины упакованы в индивидуальный контейнер одноразового использования. Материал зарегистрирован в России и внесен в Государственный реестр изделий медицинского назначения и медицинской техники (рег. удостоверение № ФС 01032006/4786-06 от 19.12.2006г.).
Цель исследования: Экспериментально доказать, что реперен не только пригоден для пластического замещения грыжевого дефекта, но и обладает рядом преимуществ перед широко используемыми в настоящее полипропиленом. Изучить в динамике течение репаративного процесса при имплантации в брюшную стенку сетчатого эндопротеза. Дать сравнительную характеристику течения раневого процесса при использовании реперена и полипропилена. Выявить особенности морфологии формирующегося рубца в зависимости от метода имплантации сетки и сроков послеоперационного периода. Применить реперен в клинике и провести анализ ближайших результатов.
Материал и методы: Изучались основные морфологические параметры реакции тканей передней брюшной стенки на использование реперена и полипропилена (эсфил) путем создания экспериментальной модели грыжевого дефекта с последующей его пластикой. Исследования проведены в соответствии с Руководством по экспериментальному (доклиническому) изучению новых фармакологических веществ (Москва, 2005г.) и действующим законодательством РФ. Работа представляет собой экспериментальное морфологическое исследование и выполнена на 77 белых беспородных крысах-самцах весом 300-400г (n=77). Животные были разделены на 6 групп (таблица 1).
Таблица 1. Распределение животных по экспериментальным группам и срокам наблюдения
На оперативном этапе эксперимента была проведена имплантация кусочков каждого материала (реперена и полипропилена) размерами 1см2 под нембуталовым наркозом (45 мг/кг, интраперитонеально) в трёх положениях: надапоневротическом (onlay), подапоневротическом (inlay) и внутрибрюшинном (sublay).
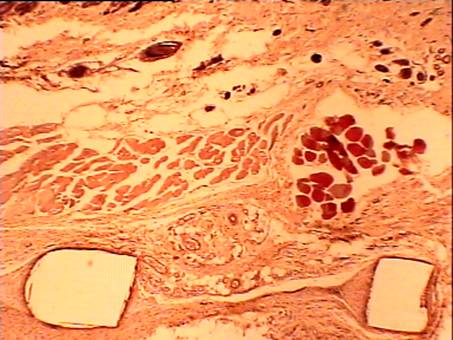
В послеоперационном периоде животные содержались в условиях вивария на стандартной лабораторной пище. Крысы после операции чувствовали себя удовлетворительно, не было отмечено изменений в поведении, потреблении воды и пищи. Выведение животных из эксперимента проведено на 7, 14, 21, 28, 90 сутки после имплантации. Данные сроки выбраны с учетом продолжительности асептического воспаления в области имплантатов, развития репаративных процессов, формирования соединительной ткани и развития полноценного послеоперационного рубца [3,4,5]. Далее было выполнено взятие участков тканей передней брюшной стенки из зон имплантации вместе с исследуемым материалом (репереном или полипропиленом) и их морфологическое исследование. Анализ гистологических препаратов выявил стереотипность признаков реакции на оба вида имплантатов, что позволило в дальнейшем обобщить полученные результаты, уточнить отдельные черты перестройки тканей, типичные для конкретного материала (рис. 17,18).
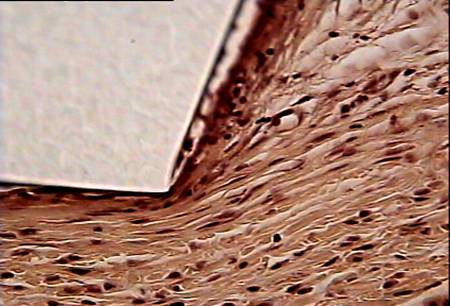
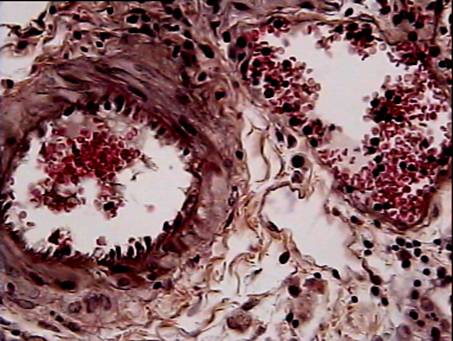
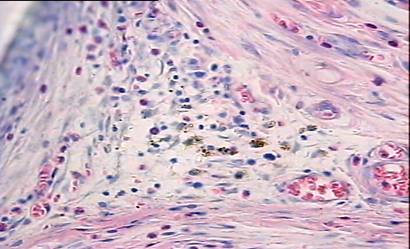
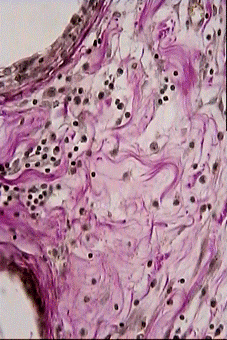
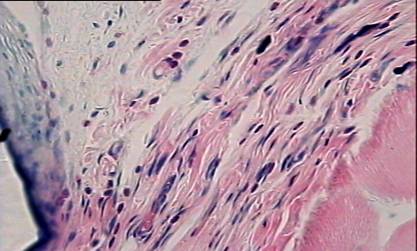
На 7 сутки после операции имплантат не плотно примыкает к окружающим тканям. Воспаление, вызванное повреждением тканей, при имплантации реперена и полипропилена выражено довольно значительно. Область непосредственного контакта ткани с имплантатом в основном заполнена эритроцитами. Часто можно видеть клетки крови, осевшие на внутренних сосудистых стенках (рис. 1).
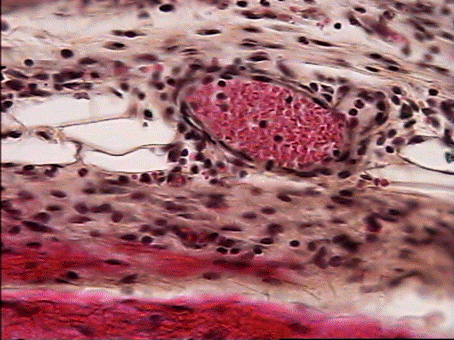
Наблюдается диапедез лейкоцитов в окружающую ткань (рис.2).
На всех препаратах в зоне имплантата локализовано большое количество палочкоядерных и сегментоядерных нейтрофилов хорошо различимых на препаратах окрашенных по Май - Грюнвальду эозином и метиленовым синим (рис. 3).
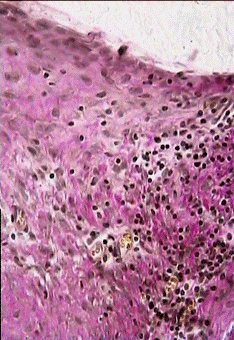
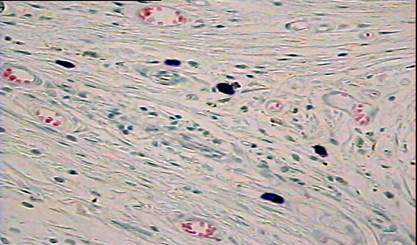
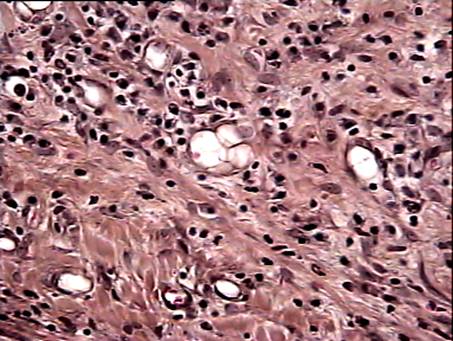
На 14 сутки после операции имплантат достаточно тесно контактирует с окружающими тканями. В зоне имплантации в основном определяются лимфоциты и моноциты (рис. 6,7).
Иногда можно наблюдать их контакты с фибробластами. Перикапиллярно локализованы тучные клетки в разных стадиях дегрануляции. При этом встречаются контакты этих клеток с макрофагами. Следует отметить, что в зависимости от места локализации очага воспаления (над апоневрозом, под апоневрозом или внутрибрюшинно), отдельные черты воспалительной реакции выражены в разной степени (рис. 8,9,10). При надапоневротическом способе имплантации сетки выявлены более поздние стадии процесса. Важно, что степень выраженности морфологической реакции варьирует и в зависимости от удаленности фрагмента сетки от её центра. Особенно это заметно в экспериментах с внутрибрюшинным расположением сеток. Скорость репаративных процессов выше на границе сетки. В центре сетки определяются признаки присущие более ранним стадиям процесса воспаления. Таким образом, основными признаками асептического воспаления в зоне имплантации сеток на 14 сутки после операции были следующие: появление значительного числа лимфоцитов, макрофагов и тучных клеток в зоне имплантации. Для этого срока наблюдения также характерна высокая гетерогенность морфологических признаков реакции в зависимости от места локализации имплантата и зоны наблюдения.
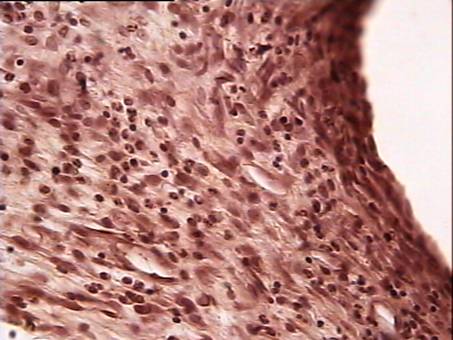
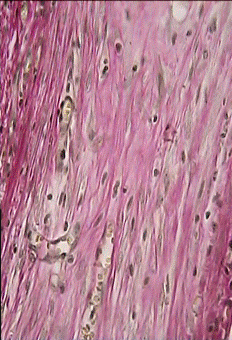
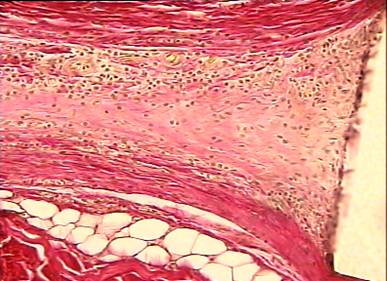
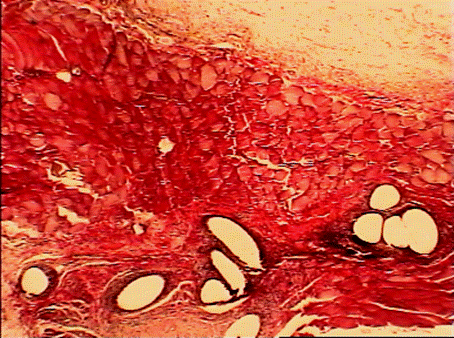
На 21 сутки после операции межклеточное вещество подкожной рыхлой соединительной ткани живота крысы представлено сетью коллагеновых и эластических волокон. Аморфная субстанция выражена слабо, она выявляется, главным образом, около мелких сосудов в виде узкого ободка. Среди волокон местами наблюдаются видоизмененные структуры: эластические волокна с выраженными деструктивными изменениями, проявляющимися во фрагментации и зернистом распаде; коллагеновые — в разволокнении и образовании по ходу их варикозных утолщений. Однако такие видоизмененные коллагеновые и эластические волокна встречаются не повсеместно, а только отдельными очагами. При окраске срезов пикрофуксином пучки коллагеновых волокон имеют тона от розовых до ярко-красных (рис. 11).
В межклеточное вещество включены клеточные элементы: фибробласты, макрофаги, тучные клетки и блуждающие элементы: лимфоциты, реже — моноциты. Периваскулярно различаются адвентициальные клетки. Численно преобладающей формой среди соединительнотканных клеток в этот период наблюдения являются фибробластические элементы. На втором месте по количеству после фибробластов стоят макрофаги (гистиоциты). Они рассеяны между фибробластическими элементами, встречаются около сосудов. Тучные клетки присутствуют относительно в небольшом числе, они обычного строения, встречаются поодиночке или небольшими группами по 2—3 (рис. 4), так же, как и гистиоциты, вокруг сосудов, реже - вдали от них. Количество капилляров заметно возрастает (рис. 12). Таким образом, основными признаками асептического воспаления в зоне имплантации сеток на 21 сутки после операции были следующие: появление значительного числа фибробластов и капилляров в зоне имплантации.
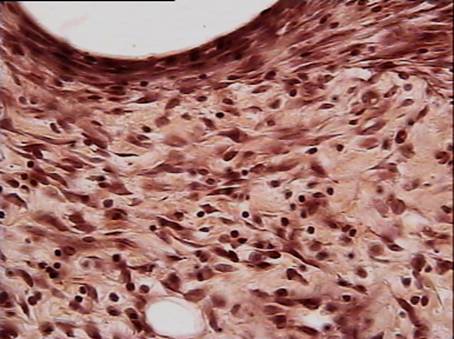
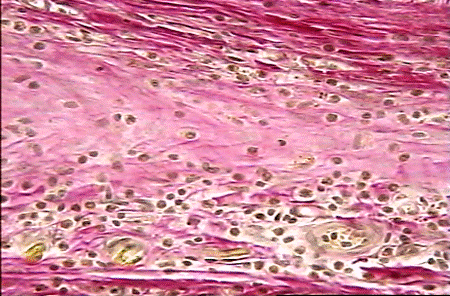
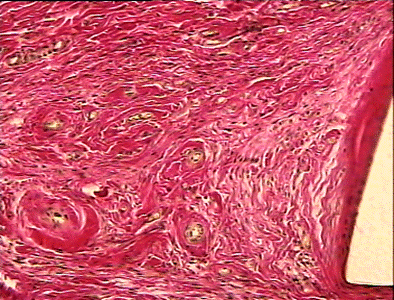
На 28 сутки после операции имплантат плотно примыкает к окружающим тканям. Клетки, подобные по морфологии большим и средним лимфоцитам, продолжают выселяться из сосудов. Возможно, часть их сохраняется от предшествующей фазы воспаления. Однако фибробласты становятся основной клеточной популяцией в исследуемой зоне. Коллагеновые волокна при окраске по Ван - Гизону имеют ярко-розовый цвет и занимают значительный объём межклеточного пространства (рис. 13). Таким образом, основной особенностью реакции тканей в зоне имплантации на 28 сутки после операции является наличие зрелых коллагеновых волокон и плотных слоёв фибробластов, окутывающих фрагменты сетки.
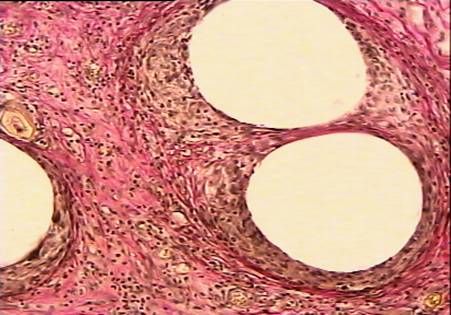
На 90 сутки после операции грануляционная ткань принимает характерную для нее архитектонику, образуя плотную капсулу вокруг элементов сетки (рис. 14). Коллагеновые волокна имеют строгую ориентацию. Численная плотность капилляров несколько снижена по сравнению с предыдущим сроком наблюдения. Структурные особенности реперена (рис. 15) в виде чёткой периодичности структурных компонентов (их одинакового диаметра и расстояния между ними) способствуют более равномерному течению процесса регенерации в зоне имплантации по сравнению с сеткой из полипропилена (рис. 16), у которой компоненты имеют различный диаметр и располагаются не на одном уровне.
C 2002 по 2006 год на базе МЛПУ «Городская больница № 35» г. Нижнего Новгорода выполнено 1043 операции по поводу грыж. 849 вмешательств (81,4%) носили плановый характер. Доля вентральных грыж составила 35,2%. 166 пациентам (53,5%) выполнена аллопластика, при чем в 2002 году синтетические сетчатые эндопротезы использовались в 27,3% случаях, а в 2006 – уже в 73,7%. Реперен применен в хирургическом лечении грыж передней брюшной стенки у 46 больных (n=46). 23 пациентов были в возрасте до 60 лет (n=23), от 60 до 74 лет у 15 чел. (n=15), старше 75 пациентов у 8 человек (n=8). В представленных группах было 11 женщин и 35 мужчин. Подавляющее число пациентов оперировано по поводу паховой грыжи (n=36 чел). У 8 пациентов предпринималось оперативное лечение по поводу пупочной грыжи по методике inlay (n=8). В 2 случаях проведена имплантация реперена по поводу послеоперационной вентральной грыжи по методике sublay (n=2). Техника операции при паховой грыже была типичной (по Лихтенштейну) (n=34). Двум пациентам (n=2) произведено грыжесечение по бесшовной методике с использованием оригинальной герниосистемы, изготовленной из реперена (рис. 19). Все операции соответствовали принципам ненатяжной герниопластики. Профилактика послеоперационных осложнений включала в себя однократное введение цефалоспоринов перед операцией, дренирование раны системой Redon. Средний послеоперационный койко-день в основной группе составил 7,8 дня, что не превышает показателей с применением полипропилена (контроль). Первичное заживление послеоперационных ран составило 100%. Отмечено также отсутствие такого явления как послеоперационная серома в зоне имплантации, типичного для имплантации полипропиленовых сеток, что существенно улучшает течение раневого процесса.
Таким образом, в ходе экспериментальной работы выявлена универсальность процессов, происходящих в зоне имплантации. Показаны преимущества реперена наряду с широко применяемым полипропиленом. Установлена зависимость скорости происходящих репаративных процессов от способа герниопластики, степени удаленности от эпицентра фрагмента имплантата. Применение реперена в клинических условиях показало его перспективность как пластического материала при хирургическом лечении вентральных грыж. Выводы: 1. Характер морфологической реакции на имплантацию эндопротеза является универсальным. 2. Скорость и интенсивность репаративного процесса существенно отличается на периферии и рядом с центром аллотрансплантата. 3. Степень выраженности тканевой реакции и темп ее развития зависит от способа имплантации (onlay, inlay, sublay). 4. По данным морфологического анализа реперен как материал для аллопластики обладает рядом преимуществ. 5. Реперен может с успехом применяться в качестве надежного материала для атензионной пластики дефектов передней брюшной стенки. 6. Использование реперена в герниологии существенно снижает риск формирования серомы послеоперационной раны. Литература
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Категория: Мои публикации | Добавил: surgeon (25.11.2007) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Просмотров: 7753 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Категории каталога
| Мои публикации [47] |
|
Герниология [14]
Материалы по хирургическому лечению грыж
|
|
Панкреатология [10]
Все материалы по хирургии поджелудочной железы
|
| Послеоперационный период. Детская челюстно-лицевая хирургия. [3] |
Поиск
Наш опрос
| Copyright MyCorp © 2025 |
| Бесплатный хостинг uCoz |