| Главная » Статьи » Мои публикации |
ПРОФИЛАКТИКА ОСЛОЖНЕНИЙ ПРИ НАЛОЖЕНИИ ХОЛЕДОХОДУОДЕНОАНАСТОМОЗА У ПОЖИЛЫХ БОЛЬНЫХ С ПОМОЩЬЮ ПРЕЦИЗИОННОГО АДАПТИРУЮЩЕГО ШВА И КСИМЕДОНА
В последние годы эндоскопические методы заняли прочные позиции в оперативном лечении осложнений острого холецистита, непроходимости желчевыводящих путей [1,2,3]. Однако в ряде случаев хирург сталкивается с необходимостью завершить вмешательство на желчных путях одним из способов внутреннего дренирования протока [4,5,6]. Надежным и доступным его вариантом является наложение холедоходуоденоанастомоза (ХДА). Самым распространенным методом формирования ХДА является латеролатеральная холедоходуоденостомия (рис. 1), выполняемая чаще всего в вариантах по Юрашу – Виноградову или Финстереру. Традиционные методики ХДА обладают рядом недостатков, которые в ряде случаев могут стать причиной осложнений и неудовлетворительных результатов:
Для адаптации краев сшиваемых тканей хирургами предложены различные виды швов. Одной из наиболее интересных модификаций является способ кишечного шва по Motson [7] (рис. 2).
При наложении такого шва хорошо фиксируются друг к другу серозные оболочки соединяемых тканей, однако отсутствует адаптация слизистых оболочек сшиваемых участков. Поэтому применение данного способа для соединения разнородных тканей (холедоха и ДПК) приводит к отсутствию биологической герметичности, заживлению линии шва вторичным натяжением с высоким риском формирования рубцовой структуры. Для улучшения процессов заживления используется метилурацил (местно в виде 0,8% раствора и внутрь в виде таблеток по 500 мг 3 раза в сутки) [8]. Однако данная методика обладает рядом недостатков:
Для профилактики осложнений в послеоперационном периоде при операции ХДА была разработана оригинальная методика холедоходуоденостомии, лишенная указанных недостатков. В качестве прототипов были взяты ХДА по Юрашу – Виноградову и способ кишечного шва по Motson.
При этом были поставлены следующие основные задачи:
В качестве средства, способного оказать подобное фармакологическое воздействие, в медицине применяется препарат ксимедон, разработанный Институтом органической и физической химии им. А.Е. Арбузова КНЦ РАН, Казанским государственным медицинским университетом [9,10]. Стимуляция заживления ран, в том числе и желудочно-кишечного тракта доказана экспериментально [11,12]. В литературе мы не встретили сообщений о местном применении ксимедона в ходе наложения ХДА и последующей локальной терапии этим препаратом.
Для решения поставленных задач был предложен и внедрен в практику способ наложения ХДА с использованием прецизионного адаптирующего шва и ксимедона [13]. На рис. 3–6 показан общий вид формирования холедоходуоденоанастомоза. Предлагаемый способ выполняли следующим образом.
Атравматичную иглу с синтетической рассасывающейся нитью 1 диаметром 4/0, предварительно импрегнированной 10% раствором ксимедона, вкалывали в стенку кишки в точке А на расстоянии 3,5 – 4 мм от края со стороны серозной оболочки 2, проводили через серозную оболочку, мышечную оболочку, подслизистую основу и слизистую оболочку 3 и выводили в точке Б (рис. 4). Затем направление иглы меняли в противоположную сторону. Иглу вкалывали в точку В, расположенную между серозной и мышечной оболочкой кишки, проводили изнутри кнаружи и выкалывали в точке Г на расстоянии 1,5 – 2 мм от края кишки (рис. 4). После чего изнутри кнаружи отступя от края на 2 мм иглу с нитью проводили через всю толщу стенки общего желчного протока 4 и выводили на его серозной оболочке в точке Д (рис. 3). После этого концы нити 1 перекрещивали между собой и натягивали в противоположные стороны (рис. 5). При этом участок слизистой оболочки 5, вывернутый наружу (рис. 6), заправлялся внутрь и не попадал в линию анастомоза. При этом совмещались серозные оболочки общего желчного протока 4 и кишки 2, а при затягивании нити прочно и точно сопоставлялись как серозные, так и слизистые оболочки общего желчного протока и кишки. Это обеспечивало полную герметичность соустья: на рис. 6 изображена зона шва после полного затягивания лигатуры.
В послеоперационном периоде проводили промывание общего желчного протока и наложенного билиодигестивного анастомоза путем введения 20 мл 10% раствора ксимедона в холедох через дренаж, per os назначали ксимедон по 0,5 г 4 раза в сутки.
Дополнительное проведение нити через серозную оболочку кишки изнутри кнаружи, ближе к краю и отступя от первого вкола кнутри без захвата других слоев позволяет погрузить вывороченную наружу слизистую оболочку внутрь просвета анастомоза и тем самым точно сопоставить сшиваемые органы серозными поверхностями для создания в конечном итоге биологической герметичности соустья. Прием, включающий в себя вторичный захват только серозной оболочки кишки, обеспечивает гемостатический эффект, так как участок слизистой оболочки, входящий в такой шов с краю, при затягивании узла прижимается к мышечно-подслизистому слою и серозной оболочке, обеспечивая надежный гемостаз. Прошивание кишки через все слои вначале снаружи внутрь, а затем дополнительное прошивание только серозной оболочки изнутри кнаружи позволяет подтянуть серозную оболочку внутрь, сместить ее еще более кнутри и тем самым точно сопоставить серозный покров кишки и общего желчного протока, который по своей толщине во многом уступает кишечной стенке.
Предложенный способ внедрен в хирургическую практику в больницах №12 и №35 г. Нижнего Новгорода. Анастомоз накладывали на воспаленных желчных путях, то есть в условиях, когда требуются наивысшие точность соединения тканей и герметичность соустья. При этом все больные, пролеченные данным способом, были старше 60 лет, имели несколько сопутствующих заболеваний и относились к группе высокого риска. Метод применен в оперативном лечении пациентов пожилого и старческого возраста с механической желтухой и гнойным холангитом, причинами которых являлись протяженный стеноз терминального отдела холедоха, множественный холедохолитиаз, рак головки поджелудочной железы. Проведен сравнительный анализ результатов лечения двух групп больных. В основную группу включили пациентов (n=21), которым был наложен холедоходуоденоанастомоз с использованием прецизионного адаптирующего шва и ксимедона. Контрольную группу составили пациенты (n=25), которым холедоходуоденостомия выполнена традиционным способом. Для оценки эффективности предложенного способа нами были взяты следующие показатели:
Все пациенты получали комплексную терапию согласно стандартам оказания медицинской помощи. Динамика основных показателей послеоперационного периода была изучена с применением методов статистики для непараметрических последовательностей и теста Манна - Уитни.
В двух группах пациентов не было достоверных отличий пола, возраста, уровней билирубина, этиологии желтухи и ее продолжительности (p>0,05 по всем вышеперечисленным параметрам). Не имели достоверных отличий также размеры холедоха по данным УЗИ и интраоперационной холангиографии (p>0,05). В то же время установлено, что у пациентов основной и контрольной групп течение послеоперационного периода имело целый ряд существенных отличий.
У пациентов основной группы общее состояние оставалось тяжелым в течение 2 суток, в контрольной - 3,5 суток (p<0.01). Средняя продолжительность пребывания пациентов основной группы в реанимационном отделении была на 36 часов меньше, чем в контрольной (рис. 7). В первой группе состояние пациентов оценивалось как удовлетворительное достоверно раньше - на 3 сутки послеоперационного периода, во второй – только через 7,25 суток (p<0,01) (Рис. 8). У больных основной группы быстрее восстанавливалась функция желудочно-кишечного тракта. В более ранние сроки наблюдалось появление перистальтики (на сутки раньше, p>0.05) и отсутствие застойного отделяемого по назогастральному зонду (с первых суток, в контроле – через 2,25 суток, p<0.01). Полное восстановление перистальтики и отхождение газов наблюдалось достоверно раньше - на 2 сутки послеоперационного периода (в контроле – через 3,5 суток, p<0.001). Это позволяло начать энтеральное питание больных основной группы практически на 2 суток раньше (p<0,001) (Рис. 9).
Основоположники билиарной хирургии (Королев Б.А., Пиковский Д.Л.) справедливо указывали, что полностью герметичных билиодигестивных анастомозов практически не бывает, что связано с физико-химическими свойствами желчи. У пациентов, оперированных с применением нашего способа, не наблюдалось примеси желчи в отделяемом из брюшной полости, отходящим по улавливающему дренажу, что доказывает герметичность наложенного анастомоза (p<0,001). Раньше и полнее происходила активизация больных и нормализация клинических и биохимических анализов.
Клинический пример. Больной Б., 70 лет, и/б №3888, поступил 15.07.2001г. в тяжелом состоянии. Диагноз: острый обтурационный флегмонозный калькулезный холецистит, множественные камни общего желчного протока, протяженный стеноз терминального отдела холедоха, гнойный холангит, механическая желтуха. Флора желчи: в титрах 105 КОЕ/мл Pseudomonas aeruginosa и Enterobacter agglomerans, резистентные к полусинтетическим пенициллинам, цефалоспоринам 3 поколения, аминогликозидам и фторхинолонам. Произведена операция: холецистэктомия, холедохолитотомия, холедоходуоденостомия с использованием прецизионного адаптирующего шва и ксимедона. По улавливающему дренажу из зоны анастомоза отделяемого нет, дренаж удален через сутки после вмешательства. Лейкоцитарный индекс интоксикации 11,5 перед операцией, спустя сутки - 5,75, через 48 час. – 1,44. Послеоперационный период гладкий, выписан на 12 день в удовлетворительном состоянии. Предложенный нами “Способ профилактики осложнений при наложении ХДА”, основанный на формировании прецизионного адаптирующего шва, системном и локальном введении ксимедона признан изобретением, получен патент РФ №2229849 от 10.06.2004г.
Таким образом, ХДА с применением прецизионного адаптирующего шва и ксимедона следует считать методом выбора у больных с механической желтухой и гнойным холангитом при наличии протяженного стеноза терминального отдела холедоха.
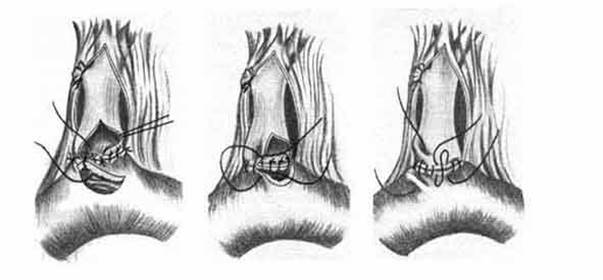 Рис. 1. Этапы формирования ХДА (традиционная методика)
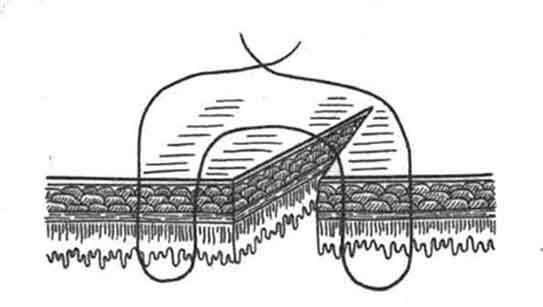 Рис 2. Способ кишечного шва по Motson
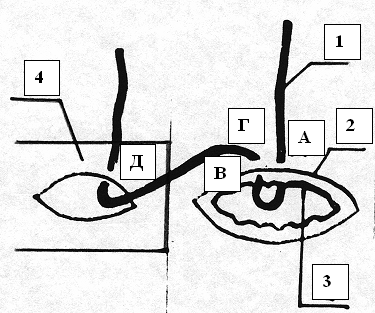 Рис. 3. Этапы формирования ХДА (метод авторов). Проведение нити через стенки ДПК и холедоха
1 – нить 2 – серозная оболочка ДПК 3 – слизистая оболочка ДПК 4 – серозная оболочка холедоха А – точка вкола иглы в серозную оболочку ДПК в 4 мм от края В – точка вкола иглы между серозной и мышечной оболочкой ДПК Г – точка выхода иглы в серозную оболочку ДПК в 2 мм от края Д – точка выхода нити через серозную оболочку холедоха 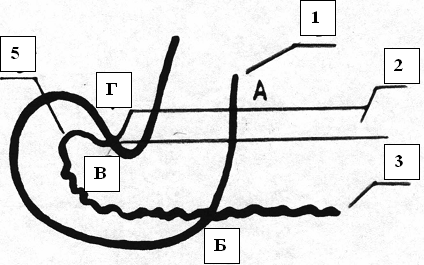 Рис. 4. Этапы формирования ХДА (метод авторов). Проведение нити через стенку ДПК
1 – нить 2 – серозная оболочка ДПК 3 – слизистая оболочка ДПК 5 - участок слизистой оболочки, вывернутый наружу А – точка вкола иглы в серозную оболочку ДПК в 4 мм от края Б – точка выхода нити через слизистую оболочку ДПК В – точка вкола иглы между серозной и мышечной оболочкой ДПК Г – точка выхода иглы в серозную оболочку ДПК в 2 мм от края  Рис. 5. Этапы формирования ХДА (метод авторов). Нити перекрещены, натянуты. Сближение стенок анастомозируемых органов
2 – серозная оболочка ДПК 4 – стенка холедоха 5 – слизистая оболочка ДПК 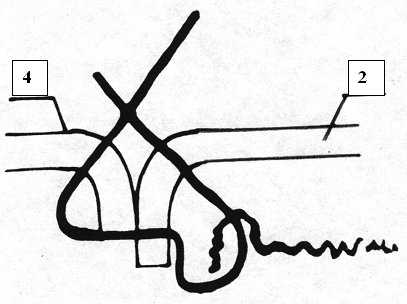 Рис. 6. Этапы формирования ХДА (метод авторов). Затягивание нити, совмещение стенок ДПК и холедоха 2 – серозная оболочка ДПК 4 – стенка холедоха 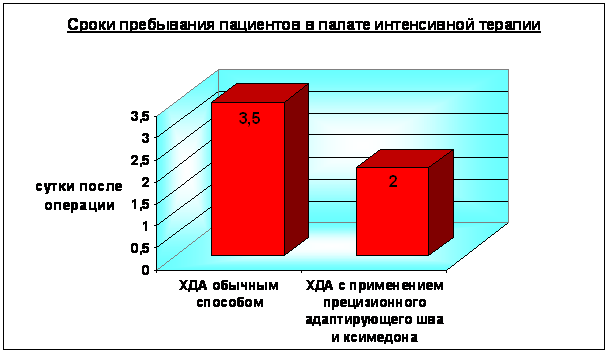 Рис. 7. Сроки пребывания в палате интенсивной терапии пациентов, перенесших холедоходуоденостомию 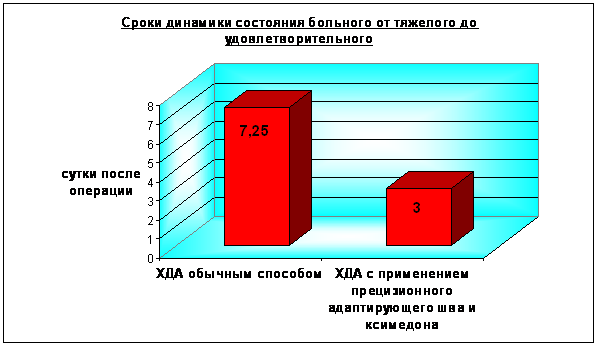 Рис. 8. Динамика состояния больных в послеоперационном периоде
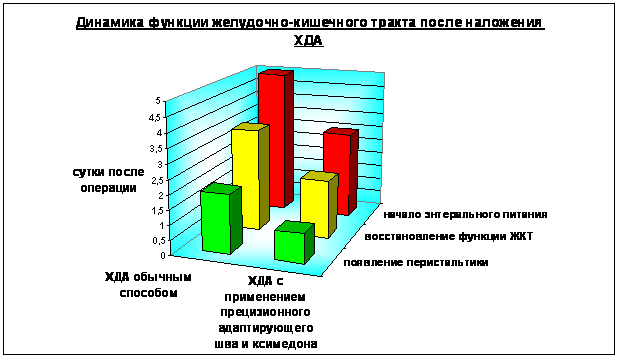 Рис. 9. Восстановление функции желудочно-кишечного тракта после холедоходуоденостомии
Литература.
| |
| Категория: Мои публикации | Добавил: surgeon (19.01.2008) | |
| Просмотров: 9439 |
Категории каталога
| Мои публикации [47] |
|
Герниология [14]
Материалы по хирургическому лечению грыж
|
|
Панкреатология [10]
Все материалы по хирургии поджелудочной железы
|
| Послеоперационный период. Детская челюстно-лицевая хирургия. [3] |
Поиск
Наш опрос
| Copyright MyCorp © 2026 |
| Бесплатный хостинг uCoz |