| Главная » Статьи » Мои публикации |
ПАТОМОРФОЛОГИЯ ПЕЧЕНИ И ВЫБОР ХИРУРГИЧЕСКОЙ ТАКТИКИ ПРИ МЕХАНИЧЕСКОЙ ЖЕЛТУХЕ У ПОЖИЛЫХ БОЛЬНЫХ. ПЕРСПЕКТИВЫ ПРИМЕНЕНИЯ ГЕПАТОПРОТЕКТОРОВ
Актуальной проблемой абдоминальной хирургии является выбор оптимальной тактики оперативного лечения обтурационного холестаза у больных пожилого и старческого возраста. Предметами обсуждения являются вопросы сроков хирургической коррекции непроходимости желчных путей, объема операции, предварительного применения декомпрессии билиарной системы малоинвазивными методами [1,2,3]. Предложе-ны многочисленные методы исследования функциональных возможностей печени, определения риска операции для оценки переносимости пациентом определенного объема вмешательства [4,5,6,7]. Тем не менее, имеется немного работ, где рассмотрена зависимость операционного риска от морфологических изменений печеночной ткани [8,9,10,11]. Остается дискутабельной роль гепатопротекторов при механической желтухе, поскольку применение их базируется только на клиническом опыте, без подтверждения морфологическими данными. Установлено, что оксидативный стресс имеет место при обтурационном холестазе, доказано его значение для течения послеоперационного периода [12,13,14]. Однако остается неясным, какие препараты следует применять при данной патологии с целью коррекции нарушений перекисного окисления липидов.
В числе применяемых мембранопротекто-ров ряд препаратов обладают существенными недостатками, что ограничивает их использование. Например, глюкокортикоиды являются иммунодепрессантами, эффект эссенциале слабый, гептрал очень дорог. В последнее время в клинической практике все чаще используется ксимедон, обладающий свойствами гепатопротектора, иммуномодулятора, стимулятора репаративных процессов, антиоксиданта, активатора тканевого дыхания, сопряженного с синтезом макроэргов, ста-билизатора состояния SH-групп, ДНК [15,16,17,18,19,20]. Появились сообщения о первом опыте применения препарата при патологии билиарной системы [21,22,23,24].
Цель исследования - изучить основные варианты течения обтурационного холестаза в зависимости от выраженности синдрома желчной гипертензии, длительности, интенсивности желтухи, ее этиологии и ультраструктурных изменений пече-ни, обосновать хирургическую тактику с позиций патоморфо-логии печени, оценить перспективы применения гепатопро-текторов. Материал и методы исследованияВ хирургическом отделении МЛПУ “Городская больница №35” г. Нижнего Новгорода за 15 лет находились 518 больных с синдромом механической желтухи, в том числе 365 пациентов пожилого и старческого возраста. Клиническую картину заболевания, биохимические и иммунохимические анализы соотносили с результатами исследований биоптатов печени методами оптической и элек-тронной микроскопии. Больные были разделены на 4 группы в зависимости от выраженности синдрома желчной гипертензии, длительности, интенсивности желтухи, ее этиологии.
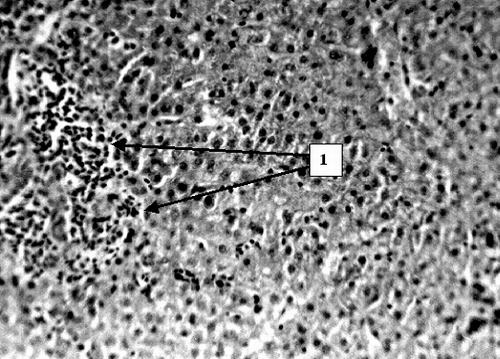
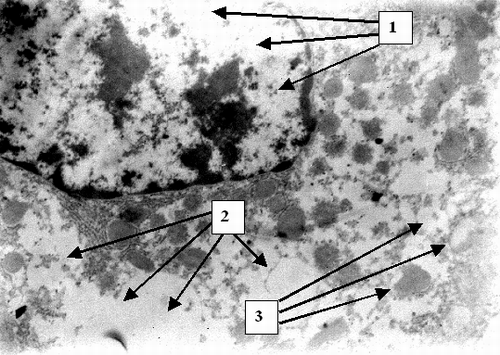
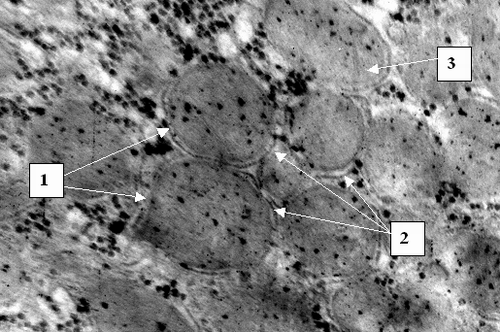
В первую группу вошли 59 пациентов с острым билиарным блоком. К ним отнесли лиц с резко выраженным синдромом желчной гипертензии. Степень последней определялась кли-нически, с учетом интенсивности приступа, динамики нарас-тания желтухи и изменения состояния больного, болевого синдрома, интоксикации, нарушений гемодинамики, измеренного во время операции остаточного давления в желчных путях. За интегральный показатель выраженности синдрома бы-ло принято нарастание уровня билирубина за сутки до 80 мкмоль/л, за 2 сут. до 150 мкмоль/л, что оценивалось как резко выраженное повышение внутрипротокового давления. Дополнительными абсолютными признаками последней были расширение внутрипеченочных желчных протоков при давности заболевания до 4 сут. и дилатация холедоха при давности обтурации до 2 сут. Гипертензия оценивалась как умеренная при нарастании уровня билирубина от 40 до 80 мкмоль/л за сут. в первые 4 дня заболевания и как незначительная при стабильных невысоких показателях билирубина. Причинами обтурационного холестаза в данной группе были ущемленные камни папиллы, множественные конкременты холедоха в сочетании со стенозом его терминального отдела. В данной категории больных выявлены следующие закономерности. У лиц с острым билиарным блоком в течение 24 часов развивается дистрофия гепатоцитов, к 48 часам до гидропической и баллонной (Рис. 1).
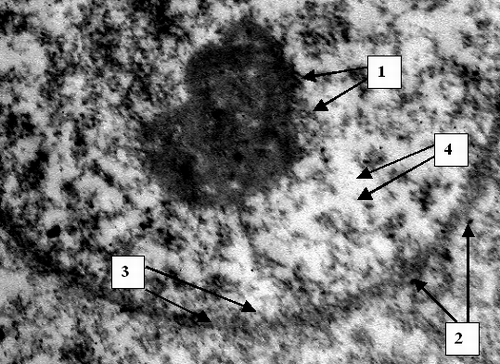
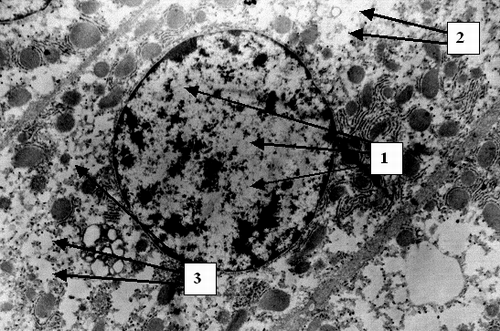
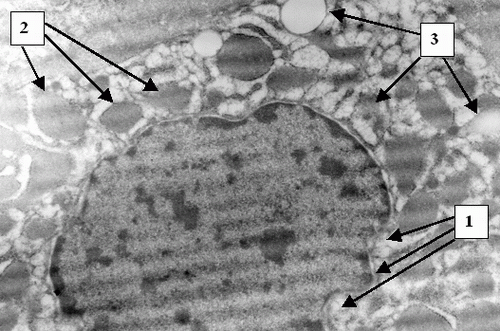
На ультраструктурном уровне к 24 часам определялась патология митохондриальных мембран, к 48 часам – патология клеточной мембраны (Рис. 2) и цитоплазматических структур, а также деструкция митохондриальных мембран (Рис. 3). К 72 часам острого билиарного блока оп-ределяются нарушение целостности ядерной мембраны и элементы кариолизиса (Рис. 4).
Таким образом установлено, что у пациентов с острым билиарным блоком происходит быстрое последовательное по-вреждение гепатоцитов на клеточном и субклеточном уровне. Последовательно развивается дистрофия – белковая, затем гидропическая и баллонная. На ультраструктурном уровне в первую очередь происходит альтерация мембран митохондрий, затем цитолеммы и кариолеммы. Эти данные подтверждают предположения ряда исследователей о патологии фосфолипидных структур в результате оксидативного стресса при меха-нической желтухе. Нарушение структуры мембран приводит к утрате клеткой и органеллами физиологической автономности и грубым функциональным расстройствам. Снижается обеспе-чение гепатоцита макроэргами, что ведет к нарушению всех видов обмена. Патоморфология клетки при острой непроходимости желчных путей детерминирует серьезный прогноз, так как в течение 48 - 72 часов развиваются изменения на грани необратимых. Обнаруженные закономерности позволяют определить сроки консервативного лечения не более чем 24 – 48 часов и диктуют необходимость экстренного оперативного вмешательства при сохраняющемся билиарном блоке. С морфологической точки зрения показано применение мембранопро-текторов. В течение первых двух суток указанные изменения носят в основном обратимый характер. Клеточные и субклеточные элементы хотя и имеют патологические изменения, но сохранены в структурном отношении. Эти данные позволяют сделать вывод о возможности радикальной оперативной коррекции непроходимости желчных путей у большинства больных. В данной категории пациентов следует выполнять не-медленное хирургическое вмешательство с полной одномоментной коррекцией патологии билиарного дерева.
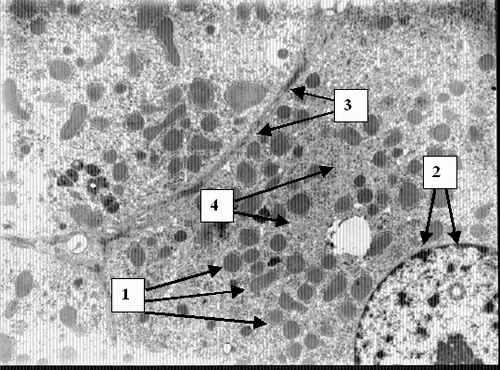
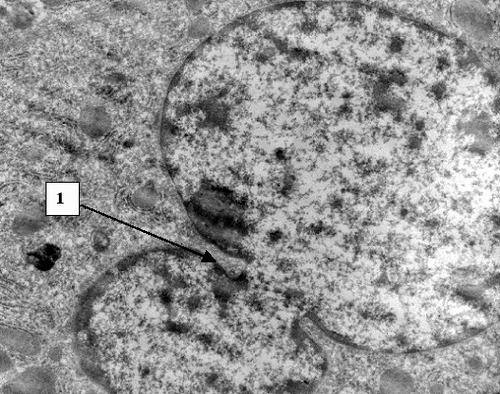
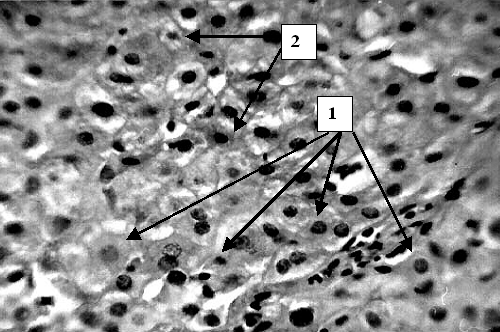
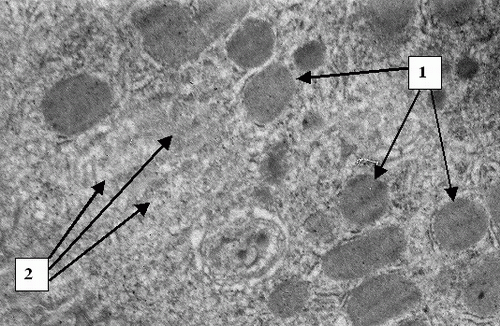
Ко второй группе отнесены 146 больных с умеренно вы-раженной желчной гипертензией, желтухой без признаков манифестированной печеночной недостаточности и тяжелого гнойного холангита (билирубин до 300 мкмоль/л, ферритин 2000 – 4000 нг/мл). Причинами обтурационного холестаза в анализируемой группе были холедохолитиаз (n=89), опухоли поджелудочной железы, желчных протоков (n=57). В данной категории пациентов на светооптическом уровне выявлена лимфогистиоцитарная инфильтрация перипортальных полей (Рис. 5), фиброз, очаги некроза гепатоцитов. На ультраструктурном уровне гепатоциты с деструкцией цитоплазматических элементов, митохондрий, кариолизисом (Рис. 6) со-седствуют со структурно и функционально сохранными клетками (Рис. 7). Присутствуют элементы регенерации - деление ядер, клеток (Рис. 8).
Таким образом, интенсивная желтуха без манифестиро-ванной печеночной недостаточности сопровождается выраженными морфологическими изменениями на клеточном и субклеточном уровнях. При умеренно выраженной желчной гипертензии процессы альтерации протекают не столь стремительно, как при остром билиарном блоке, а патология мембранных комплексов не носит катастрофического, лавинообразного характера. Поэтому сроки оперативной коррекции в данной группе больных могут определяться не так жестко. Хирург располагает временем на предоперационную подготовку, более детальное обследование и коррекцию сопутствующей патологии. Вместе с тем, при продолжительной желтухе происходят довольно глубокие сдвиги на уровне гепатоцита и его ультраструктуры, что физически снижает функциональные резервы печени. Это проявляется видимым уменьшением количества активно функционирующих гепатоцитов. В клетках происходит обеднение цито- и кариоплазмы, снижение количества органелл и их альтерация. Поэтому объем хирургического вмешательства следует ограничить, операция должна быть выполнена по возможности быстро и надежно. В пред- и послеоперационном периоде целесообразно применение стимуляторов репаративных процессов. В данной группе пациентов после предоперационной подготовки в течение 24–48 часов следует выполнять оперативное вмешательство в объеме, не превышающем наложения билиодигестивного анастомоза.
Третью группу составили 53 пациента с длительной, интенсивной желтухой и манифестированной печеночной недостаточностью, тяжелым гнойным холангитом (давность заболе-вания более 20 суток, билирубин свыше 300 мкмоль/л, ферритин 4000–8000 нг/мл). Причинами обтурационного холестаза были опухоли поджелудочной железы, желчных протоков (n=38), холедохолитиаз и стеноз терминального отдела холедоха (n=15). В данной категории больных на светооптическом уровне выявлены лимфогистиоцитарная инфильтрация перипортальных полей, фиброз, очаги некроза гепатоцитов. На ультраструктурном уровне обнаружена практически тотальная деструкция цитоплазматических элементов, митохондрий, кариолизис (Рис. 9, 10).
Таким образом, в данной категории пациентов с дли-тельной интенсивной желтухой и манифестированной печеночной недостаточностью морфологически детерминирован крайне высокий операционный риск. На препаратах печени в этой группе пациентов выявлено повреждение ключевых субклеточных структур, близкое к необратимым изменениям, что делает гепатоцит в ряде случаев нежизнеспособным. На большом клиническом опыте мы убедились, что у таких больных одно-моментная коррекция непроходимости желчных путей сопрово-ждается очень тяжелым послеоперационным периодом. С морфологической точки зрения объем оперативного вмешательст-ва следует определить минимальным – наружное дренирование билиарной системы на основе малоинвазивных технологий. После предоперационной подготовки в течение 12–24 часов следует выполнять декомпрессивное вмешательство – холецистостомию из минидоступа в случае желчного пузыря in situ, пункционную холангиостомию под УЗИ – контролем, если пузырь удален ранее, либо имеется высокий билиарный блок. Через 10–14 суток решается вопрос о втором этапе хирургического лечения (внутреннее дренирование желчных путей). В эти сроки гистологическая картина печени становится близка к патоморфологическим изменениям гепатоцитов во второй группе больных. При продолжительном наружном дренировании желчных путей (свыше 20 суток) у больных развивается ахолический синдром. Таким образом, оптимальными сроками выполнения второго этапа хирургического лечения следует считать 10–20 сутки после декомпрессии билиарной системы.
К четвертой группе отнесены 107 больных с желтухой небольшой интенсивности, минимальной желчной гипертензией, билирубином не более 100 мкмоль/л, длительностью заболевания до 7 сут. Причинами обтурационного холестаза были единичные конкременты холедоха, панкреатит. На светооптическом уровне выявлены начальные формы дистрофий гепатоцитов (Рис. 11), на ультраструктурном – большинство мембранных комплексов сохранено, отмечается набухание ми-тохондрий, неоднородность матрикса (Рис. 12).
Таким образом, в группе лиц с желтухой небольшой интенсивности и минимальной желчной гипертензией гистологические и ультраструктурные изменения свидетельствуют о минимальном повреждении печеночной ткани. По данным морфологических исследований, в данной группе пациентов операционный риск незначительный. Следует считать возможным выполнение хирургических вмешательств любого необходимого объема. Вопрос об экстренности операции теряет свою актуальность. Анализируя картину ультраструктурных изменений печени при механической желтухе, мы пришли к выводу, что степень патоморфологических сдвигов зависит от этиологии процес-са, тяжести холестаза и его продолжительности. При желтухе доброкачественного происхождения основным механизмом повреждения печеночных клеток и причиной развития острой печеночной недостаточности является феномен дистрофии. Пусковым фактором развития последней служит гипоксия клеток печени вследствие повышения внутрипротокового давления и нарушений регионарной гистоперфузии.
При опухолевой обтурации протоков желчная гипертензия развивается постепенно, поражение печени часто является более тяжелым, чем при холедохолитиазе, но менее острым. В ряде случаев даже при интенсивной продолжительной желтухе мембранные комплексы гепатоцитов сохранены (Рис. 13). Эти данные соответствуют результатам биохимических исследований - синдром цитолиза преобладает над синдромом холестаза при желтухе неопухолевого генеза. В целом степень повреждения биомембран зависит от выраженности желчной гипертензии и ее продолжительности. При медленном нарастании желтухи успевают развиться компенсаторные механизмы – деление клеток, элементы регенерации, относительно сохраненные структура и функция одних гепатоцитов взамен деградирующих соседних клеток. В данном случае пациенту необходимо применение медикаментов, стимулирующих репаративные, регенераторные процессы. При интенсивной длительной желтухе наблюдается повсеместная гибель органелл и нуклеолизис. Прогноз послеоперационного периода в таких случаях весьма серьезный. Применение мембранопротекторов и стимуляторов регенерации возможно, однако большого эффекта ожидать не следует, так как практически отсутствуют основные мишени их воздействия. На основании данных электронной микроскопии мы сочли необходимым включение в лечебную программу больных с механической желтухой в до- и послеоперационном периоде современного препарата, обладающего свойствами мембранопротектора и стимулятора регенерации - ксимедона в дозе 2 г в сутки. Применение ксимедона позволило расширить круг пациентов, которым может быть успешно выполнена радикальная одномоментная коррекция непроходимости желчных путей.
Клинический пример. Больной Б., 70 лет, и/б №3888, поступил 15.07.2001г. в тяжелом состоянии. Диагноз: острый обтурационный флегмонозный калькулезный холецистит, множественные камни общего желчного протока, протяженный стеноз терминального отдела холедоха, гнойный холангит, механическая желтуха. Флора желчи: в титрах 105 КОЕ/мл Pseudomonas aeruginosa и Enterobacter agglomerans, рези-стентные к полусинтетическим пенициллинам, цефалоспоринам 3 поколения, аминогликозидам и фторхинолонам. Интраопера-ционная биопсия печени: деструкция значительного числа митохондрий, патология ядра гепатоцита (Рис. 14).
Произведена операция: холецистэктомия, холедохолитотомия, холедоходуоденостомия с использованием прецизионного адаптирующего шва и ксимедона. По улавливающему дренажу из зоны анастомоза отделяемого нет, дренаж удален через сутки после вмешательства. Лейкоцитарный индекс интоксикации 11,5 перед операцией, спустя сутки - 5,75, на второй день послеоперационного периода – 1,44. Послеоперационный период гладкий, выписан на 12 день в удовлетворительном состоянии.
Таким образом, активная хирургическая тактика при обтурационном холестазе и более частое применение этапного лечения малоинвазивными методами при механической желтухе опухолевого генеза являются морфологически обоснованными. С учетом данных электронной микроскопии печени при механической желтухе, применение гепатопротекторов (ксимедон) показано при выраженном синдроме желчной гипертензии, интенсивной длительной желтухе, гнойном холангите и абсолютно необходимо при острой обструкции желчных путей (ущемленный камень папиллы). Использование препарата позволяет существенно расширить круг лиц, которым может быть выполнена радикальная одномоментная коррекция непро-ходимости желчных путей.
Выводы:
Литература
| |||||||||||||||||||||||||||||
| Категория: Мои публикации | Добавил: surgeon (19.01.2008) | |||||||||||||||||||||||||||||
| Просмотров: 6284 | |||||||||||||||||||||||||||||
Категории каталога
| Мои публикации [47] |
|
Герниология [14]
Материалы по хирургическому лечению грыж
|
|
Панкреатология [10]
Все материалы по хирургии поджелудочной железы
|
| Послеоперационный период. Детская челюстно-лицевая хирургия. [3] |
Поиск
Наш опрос
| Copyright MyCorp © 2026 |
| Бесплатный хостинг uCoz |