| Главная » Статьи » Герниология |
Введение. Ненатяжная пластика с применением сетчатых эндопротезов является методом выбора в современной герниологии, который способен обеспечить эффективность вмешательства и высокие показатели качества жизни в отдаленные сроки после операции [2,9,10]. Среди всех вариантов закрытия дефекта брюшной стенки при вентральной грыже наибольшего внимания заслуживает способ IPOM (intraperitoneal onlay mesh) [1,20]. В эксперименте показано, что репаративный процесс при внутрибрюшинном расположении сетки протекает относительно медленно, с минимальной интенсивностью воспалительной реакции [11]. Применение данной техники ассоциировано с наименьшей частотой рецидивов грыж, а сама методика операции проста и доступна в освоении [5,20]. Основные вопросы, которые находятся в поле зрения хирургов – надежность фиксации эндопротеза, эффект усадки (сморщивания) сетки, выраженность спаечного процесса в брюшной полости и профилактика осложнений [2,13,15,17]. Интересным направлением решения актуальных задач герниологии является клеевая фиксация сетки, которая имеет ряд преимуществ перед традиционным применением швов и скрепок [3]. Показано, что репаративный процесс протекает благоприятно, а сама пластика достаточно надежна [7,8]. Ряд авторов высоко оценивает возможности ненатяжной пластики брюшной стенки с применением клея; количество российских работ в этом разделе пока небольшое [7,8,12,18]. Вызывает интерес возможность положительного влияния на зону произведенной пластики препаратами, относящимися к категории стимуляторов репаративного процесса. Наиболее перспективным из них является ксимедон (группа пиримидиновых производных) [4]. Его рекомендуемая лечебная доза для лабораторных животных составляет 100 мг/кг [4]. Однако в настоящее время сложно предсказать влияние таких лекарственных средств на спаечный процесс в брюшной полости, поскольку стимуляция синтеза коллагена здесь может быть опасной. Цель работы: экспериментальное
обоснование интраперитонеальной пластики брюшной стенки с помощью клеевой
композиции и стимуляторов репаративного процесса. Материал и методы. В эксперименте
моделирована интраперитонеальная пластика брюшной стенки синтетическими
эндопротезами. Работа проведена в полном соответствии с действующим
законодательством РФ ("Правила гуманного обращения с лабораторными животными”)
и методическими указаниями Минздрава РФ ("Деонтология медико-биологического
эксперимента”). Операции выполнены крысам в условиях
общей анестезии нембуталом 45 мг/кг внутрибрюшинно. В основной группе осуществлена
интраперитонеальная пластика с фиксацией синтетического эндопротеза клеевой
композицией на основе сульфакрилата, никакие швы при этом не использовали (n=34). В контрольной группе
произведена интраперитонеальная пластика с фиксацией синтетического эндопротеза
швами нерассасывающейся полипропиленовой нитью (Prolen 4\0) общепринятым
способом (n=21).
Сравнили также результаты локального применения ксимедона (IPOM, n=18) с контролем (IPOM, без ксимедона, n=37). Ксимедон вводили в предбрюшинное
пространство зоны имплантации сетки путем инъекции 0,6 мл 5% раствора
(100мг/кг). Применены сетки из стандартного полипропилена и реперена размерами
1х1см, распределение типов эндопротезов в группах не имело значимых отличий. Методики
вмешательств соответствовали принятым в как в клинической практике, так и в
эксперименте, подробно описанным в литературе. Животные выведены из
эксперимента в сроки 14, 21, 28, 90 суток. Изучили прочность фиксации эндопротеза к
тканям брюшной стенки и спаечный процесс в брюшной полости. Для количественной
оценки служила модифицированная Вандербильтская шкала [6]. Результаты анализировали
статистически с помощью теста Mann-Whitney средствами Origin Pro в среде
Windows 7 на компьютере Emachines. Фазы репаративного процесса отслеживали
гистологически. В качестве биопсийного материала брали участки брюшной стенки
из зон имплантации, фиксировали 10% нейтральным формалином с последующей
парафин – целлоидиновой обработкой, заливали в парафин, изготовливали срезы на
микротоме, окрашивали гематоксилином – эозином, просматривали на микроскопе
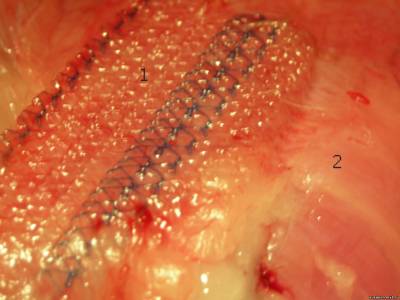
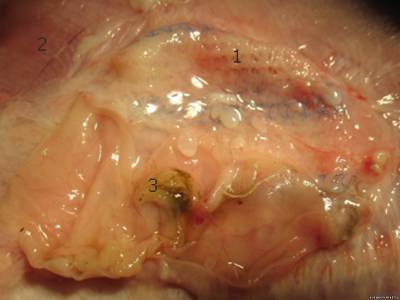
Leica при увеличении х400. Результаты. Прочность фиксации сетки к брюшной стенке в анализируемых группах составила 2,83 и 2,35 баллов соответственно, p=0,0004. Таким образом, применение клеевой композиции при выполнении интраперитонеальной пластики достоверно улучшает прочность фиксации сетки к тканям брюшной стенки. В основной группе выраженность спаечного процесса составила в среднем 2,6 балла, в контрольной 3,8 балла, p=0,02. При использовании клея для интраперитонеальной пластики сеткой выраженность спаечного процесса достоверно меньше. При локальном использовании ксимедона в зоне пластики прочность фиксации сетки оказалась выше, чем в контрольной группе (3 балла и 2,48 балла соответственно, p=0,0004). В группе с применением ксимедона выраженность спаечного процесса составила 2,61 балла, а в контроле – 3,24 балла, p=0,24. На иллюстрации показан результат имплантации сетки с ее фиксацией к брюшной стенке клеем. Спаечный процесс отсутствует, сетка адекватно фиксирована к брюшной стенке на всей площади, сморщивания эндопротеза нет (рис. 1). На другой фотографии хорошо заметен эффект сморщивания сетки после традиционной фиксации швами, в нижней части находится слизистая кишки (рис. 2). К эндопротезу
настолько плотно приращена толстая кишка, что отделить последнюю от сетки без
вскрытия просвета крайне сложно. Таким образом, интраперитонеальная пластика
брюшной стенки с помощью синтетических эндопротезов с применением клея – простой
и надежный способ, который обеспечивает надежную фиксацию сетки к брюшной
стенке и сопровождается минимальным спаечным процессом в брюшной полости.
Применение ксимедона улучшает прочность фиксации сетки к тканям и интеграцию
эндопротеза в брюшную стенку. Использование препарата не увеличивает
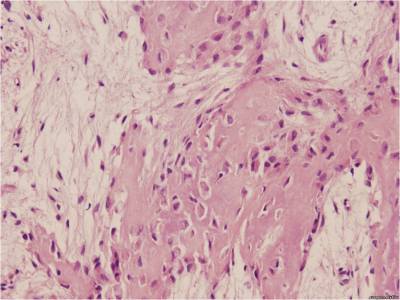
выраженность спаечного процесса в брюшной полости. Обсуждение. В настоящее время опыт использования клеевой фиксации сетки для ненатяжной пластики брюшной стенки пока небольшой, а сведений о применении цианакрилатных композиций совсем немного. Данные различных авторов о результатах анализируемой методики иногда противоречат друг другу [16,19]. Некоторые исследователи сообщают о негативном воздействии клея на репаративный процесс [14]. Однако другие ученые подчеркивают, что такое явление может быть при избыточном нанесении клея, а при адекватном его применении такого явления не отмечено [7]. Наши результаты также свидетельствуют об оптимальном течении репаративного процесса, минимальном воспалительном компоненте и хорошей интеграции сетки в ткани брюшной стенки. На иллюстрации показано формирование зрелой соединительной ткани в зоне имплантации (рис. 3). Это согласуется с результатами экспериментальных
исследований наших российских коллег [7,8]. Приведенные результаты не
противоречат сведениям ряда зарубежных публикаций о положительном клиническом
опыте использования клея в герниологической практике [12,18]. Изучение местного
эффекта ксимедона при интраперитонеальной пластике показало, что закономерности
положительного действия препарата на раневой процесс соблюдаются и здесь, а высказанные
авторами в начале исследования опасения относительно спаечного процесса были преувеличенными.
Не исключено, что благоприятное течение послеоперационного периода связано со
стимуляцией ксимедоном естественных механизмов репаративной регенерации и
противовоспалительным эффектом данного препарата, которые были выявлены ранее [4]. Заключение. Использование клеевой
композиции в ходе интраперитонеальной пластики следует рассматривать как
альтернативу традиционному способу фиксации эндопротеза с помощью швов. Метод
достоверно увеличивает прочность фиксации сетки к тканям брюшной стенки в
послеоперационном периоде. Данный способ статистически значимо снижает выраженность
спаечного процесса в брюшной полости. Использование ксимедона позволяет
добиться максимально прочной фиксации сетки к тканям брюшной стенки, но не
стимулирует образование спаек в брюшной полости. Применение клеевых композиций
для ненатяжной пластики представляется перспективным направлением в современной
герниологии и требует дальнейшего изучения.
Литература. 1.
Богдан В.Г. Интраперитонеальная и
подапоневротическая пластика в лечении послеоперационных грыж живота.
Герниология 2009: 3(23); 6. 2.
Егиев В.Н., Лядов К.В., Воскресенский
П.К. Атлас оперативной хирургии грыж. М., Медпрактика – М, 2003: 228. 3.
Егиев В.Н., Лядов К.В., Ермаков Н.А.
Клеевая фиксация протезов при лапароскопической герниопластике: первый опыт.
Герниология 2009; 3(23): 14. 4.
Измайлов С.Г., Паршиков В.В. Ксимедон:
настоящее и будущее. Нижегородский медицинский журнал 2002; 3: 81 - 87. 5.
Иоффе А.Ю., Захараш М.П., Абу-Шамсия Р.
Методика интраперитонеальной герниопластики с использованием композитной сетки
Proceed. Герниология 2009; 3(23): 17. 6.
Лядов В.К. Сравнительная оценка
материалов для внутрибрюшинного размещения при лечении грыж передней брюшной
стенки. Экспер. - клин. исследование. Автореф. дисс… канд. мед наук. Москва
2010: 18. 7.
Марченко В.Т., Шкурупий В.А.
Морфологические особенности репаративной регенерации органов и тканей при
использовании сульфакрилата нового поколения. Бюлл экспер биол и мед 2004;
2(137): 1-4. 8.
Наумов Б. А., Чернооков А. И., Шехтер А.
Б. и др. Морфологическая оценка заживления раны при различных способах пластики
дефектов передней брюшной стенки у экспериментальных животных и грыжесечение с
протезирующей реконструктивной пластикой у больных с ущемленными
послеоперационными вентральными грыжами с использованием фибринового клея.
Анналы хирургии 2010; 4: 37-45. 9.
Сажин В.П., Климов Д.Е., Сажин И.В. и
др. Ненатяжная пластика передней брюшной стенки при ущемленных
послеоперационных вентральных грыжах. Хирургия 2009; 7: 4-6. 10.
Седов В.М., Гостевской А.А., Тарбаев
С.Д. и др. Сетчатые имплантаты из поливинилиденфторида в лечении грыж брюшной
стенки. Вестник хирургии им. И.И. Грекова 2008; 2: 16-21. 11.
Экспериментально - клиническое
обоснование применения синтетического материала "Реперен" в
хирургическом лечении грыж передней брюшной стенки. Романов Р.В., Паршиков
В.В., Градусов В.П.и др. Нижегородский медицинский журнал 2008; 1: 53-59. 12.
Campanelli
G., Champault G., Pascual M.H. et al. Randomized, controlled, blinded trial of
Tissucol/Tisseel for mesh fixation in patients undergoing Lichtenstein
technique for primary inguinal hernia repair: rationale and study design of the
TIMELI trial. Hernia 2008; 12: 159–165. 13.
Crovella
F., Bartone G., Fei L. Incisional hernia. Incisional hernia. Springer 2007:
261. 14.
Fortelny
R.H., Petter-Puchner A.H., Walder N. Cyanoacrylate tissue sealant impairs
tissue integration of macroporous mesh in experimental hernia repair. Surg
Endosc 2007; 21(10): 1781-5. 15.
Jonas
J.The problem of mesh shrinkage in laparoscopic incisional hernia repair.
Zentralbl Chir 2009; 134(3): 209-13. 16.
Kim-Fuchs
C., Angst E., Vorburger S. et al. Prospective randomized trial comparing
sutured with sutureless mesh fixation for Lichtenstein hernia repair: long-term
results. Hernia 2011 Jul: 26. 17.
Loos
M.J.A., Roumen R.M.H., Sheltinga M.R.M. Chronic sequelae of common elective
groin hernia repair. Hernia 2007; 11: 169–173. 18.
Morales-Conde
S., Socas M., Barranco A. et al. Systematic review of the use of fibrin sealant
in abdominal wall repair surgery. Hernia 2011; 15(Suppl 2): 62. 19.
Paajanen
H., Kössi J., Silvasti S. Randomized clinical trial of tissue glue versus
absorbable sutures for mesh fixation in local anaesthetic Lichtenstein hernia
repair. Br
J Surg 2011; 98(9): 1245-51. 20. Williams R.F., Martin D.F., Mulrooney M.T., Voeller G.R. Intraperitoneal modification of the Rives-Stoppa repair for large incisional hernias. Hernia 2008; 12: 141-145. | |
| Категория: Герниология | Добавил: Vladimir (24.06.2012) | |
| Просмотров: 3108 |
Категории каталога
| Мои публикации [47] |
|
Герниология [14]
Материалы по хирургическому лечению грыж
|
|
Панкреатология [10]
Все материалы по хирургии поджелудочной железы
|
| Послеоперационный период. Детская челюстно-лицевая хирургия. [3] |
Поиск
Наш опрос
| Copyright MyCorp © 2025 |
| Бесплатный хостинг uCoz |